Introduction - ce que le ciel nous dit sur la lumière
La lumière du soleil apparaît légèrement jaune le matin, idéalement un ciel bleu à midi et se change en un beau rouge au coucher du soleil. Ceci décrit parfaitement la distribution spectrale de la lumière, car la lumière se compose de plusieurs couleurs avec des longueurs d'onde différentes. Les particules et molécules présentes dans l'atmosphère diffusent la lumière en fonction de leur taille. Les particules plus grosses comme les gouttelettes d'eau ou les cristaux de glace réfléchissent la lumière et apparaissent blanches. Les particules plus petites produisent de la lumière parasite et, par exemple, la couleur bleue avec une courte longueur d'onde est diffusée plus que la lumière rouge. C'est pourquoi le ciel apparaît bleu à midi, mais devient rouge (longueur d'onde plus longue pour le plus long trajet de la lumière) au coucher du soleil.
Cela dit, le comportement spectral de la lumière peut être parfaitement utilisé pour identifier les couleurs et les particules. C'est ce que font les capteurs optek. Le faisceau lumineux d'une source lumineuse définie traverse un échantillon et les détecteurs mesurent la lumière qui passe, par exemple directement à 0° ou la lumière diffusée à des angles de 11° ou 90°. Le résultat est toujours l'intensité lumineuse passant à travers un échantillon. Dans le cas d'un étalonnage d'un système utilisant des étalons définis (p. ex. filtres optiques ou étalons de turbidité), ce résultat peut être utilisé pour l'analyse qualitative et quantitative. La technique de mesure utilisée et les longueurs d'onde choisies constituent les différentes méthodes d'analyse.
loi Lambert-Beer
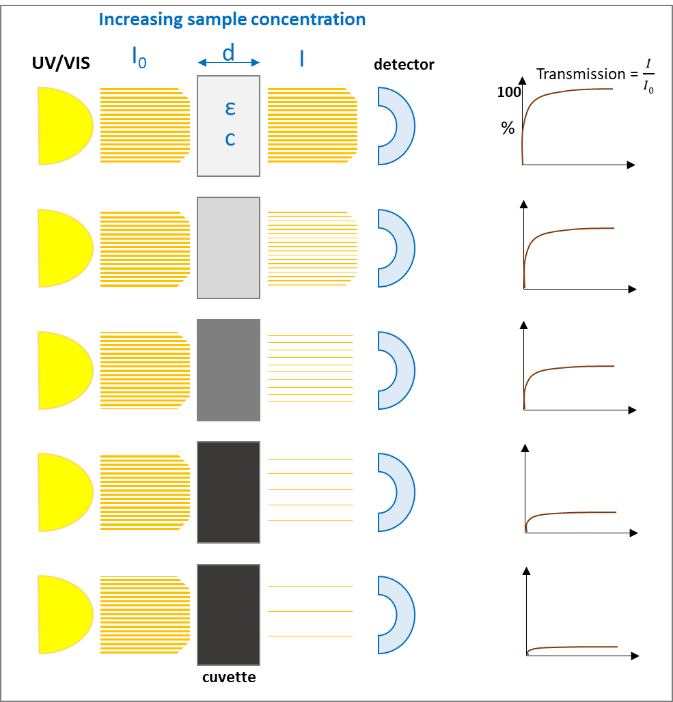
Une source de lumière monochromatique, par exemple UV/VIS avec l'intensité I0 passe une solution diluée d'une substance chimique spécifique de l'épaisseur d et donne une intensité I. La lumière qui passe à travers la solution donne l'effet suivant

qui diminue de façon exponentielle avec l'augmentation de la concentration (c) de la solution et avec l'épaisseur (d) de la cuvette :
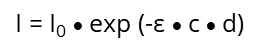
Après réaménagement, nous obtenons la "loi Lambert-Beer" :
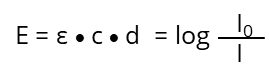
- Io : Intensité du faisceau lumineux avant la solution
- I : Intensité du faisceau lumineux après passage de la solution avec une épaisseur d
- d : épaisseur d, ou trajet du faisceau optique (cm)
- c : concentration de la substance absorbante en moles l-1.
- ε : coefficient d'extinction molaire à longueur d'onde spécifique pour cette substance en l mol-1 cm-1.
- E : extinction
Dans le cas idéal (ε) est dans des conditions de mesure contrôlées (température, solvant, pH, etc.) en fonction de la substance absorbante et de la longueur d'onde (λ). Il s'agit d'une constante et n'est pas influencé par (c), énumérés dans divers tableaux pour de nombreux produits chimiques. Si la longueur du trajet optique (d) et la substance chimique sont connues (tout comme ε), la concentration inconnue (c) d'une substance peut être déterminée en mesurant l'extinction (E) à une longueur d'onde spécifique :
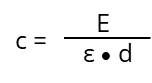
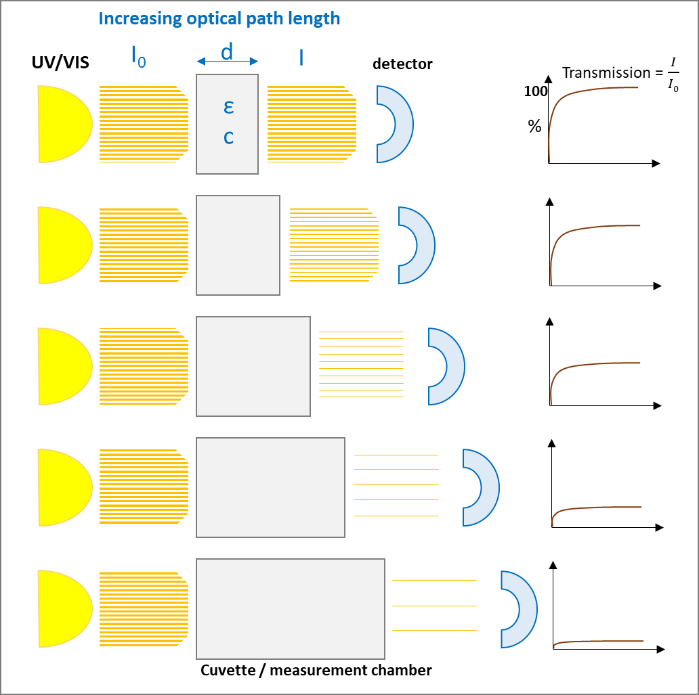
Les figures suivantes (1 et 2) illustrent les deux effets sur la loi Lambert-Beer :
Que détecte-t-on lorsque la lumière traverse un échantillon ?
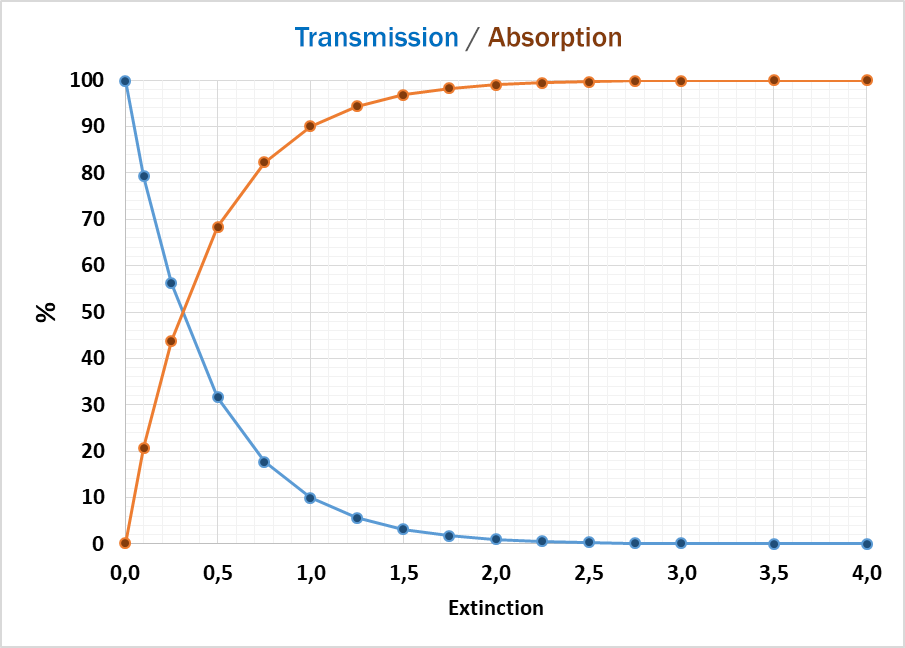
En général, deux résultats principaux peuvent être obtenus : la valeur pour la lumière absorbée ou pour la lumière transmise.
L'absorption de la lumière, lors du passage à travers un échantillon, dépend principalement de la composition / structure de l'échantillon et de la fréquence de la lumière (longueur d'onde). Selon la loi de Lambert-Beer, l'intensité de la lumière traversant l'échantillon est proportionnelle au coefficient d'absorption et à la longueur du trajet optique (épaisseur de l'échantillon).
Si l'échantillon absorbe la plus grande partie de la lumière, la précision de la détection des traces de produits chimiques se détériore, car la courbe d'absorption est plus plate et les petits changements ne peuvent être détectés de façon fiable. Dans ce cas, une dilution de l'échantillon ou une plus petite longueur de trajet optique (épaisseur de l'échantillon) peut aider à obtenir des valeurs d'absorption plus élevées et des résultats plus précis.
A l'autre extrémité de l'échelle d'absorption, une trop grande quantité de lumière traversant l'échantillon peut également entraîner des résultats peu fiables. Ensuite, un chemin optique plus grand (épaisseur) peut aider à réduire l'absorption à des niveaux inférieurs, où le détecteur peut mieux gérer la quantité de lumière.

Figure 4 : partie du spectre des ondes électromagnétiques.
L'énergie de la source lumineuse peut être caractérisée par la longueur d'onde. Plus la longueur d'onde est petite, plus l'énergie fournie par les ondes électromagnétiques dans l'échantillon est importante et plus les électrons sont excités à des niveaux d'énergie plus élevés, ou bien les parties de la molécule se balancent et se courbent. Les capteurs optiques d'optek utilisent les plages de longueurs d'onde UV ou VIS ou NIR dans différentes configurations, pour des performances optimales en mesures optiques.
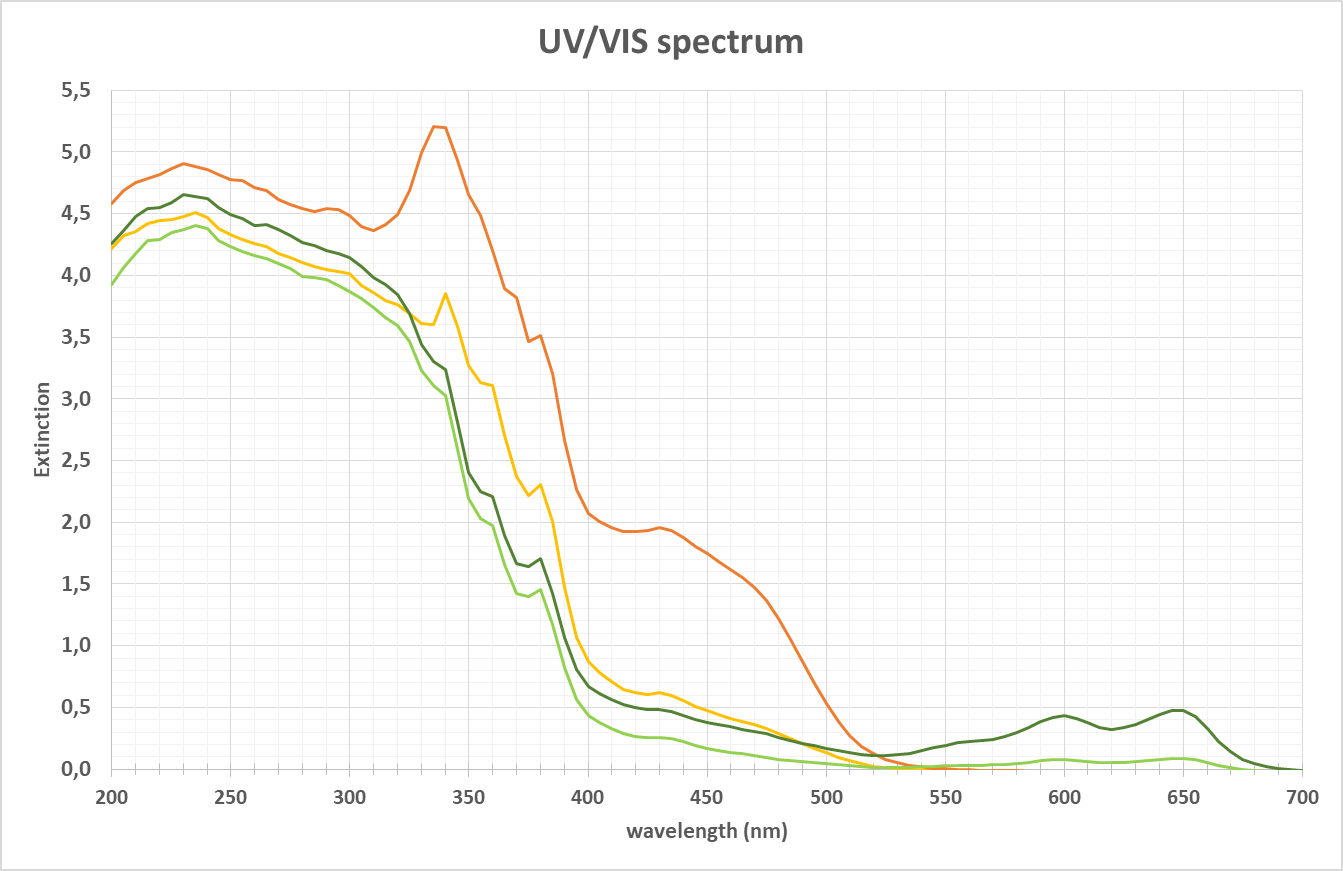
Spectre d'un échantillon dans la gamme UV-VIS
Lorsqu'un échantillon contenant des substances chimiques est placé dans une source de lumière d'une longueur d'onde de 200 à 700 nm, par exemple, les molécules absorbent une certaine lumière à des longueurs d'onde spécifiques. Comme nous l'avons vu plus haut, ce type de spectre peut en être le résultat. Il dépend de la caractéristique de la substance chimique d'identifier une zone de longueur d'onde, où les formes / pics dans les spectres peuvent être utilisés pour analyser, par exemple, la couleur, la concentration, les changements structurels (par exemple, les changements de pH) ou la turbidité. La détection de la lumière traversant l'échantillon peut se faire dans différentes directions. La technique la plus courante consiste à mesurer la transmission lumineuse (ou l'absorption réciproque). L'angle de détection est de 0°.
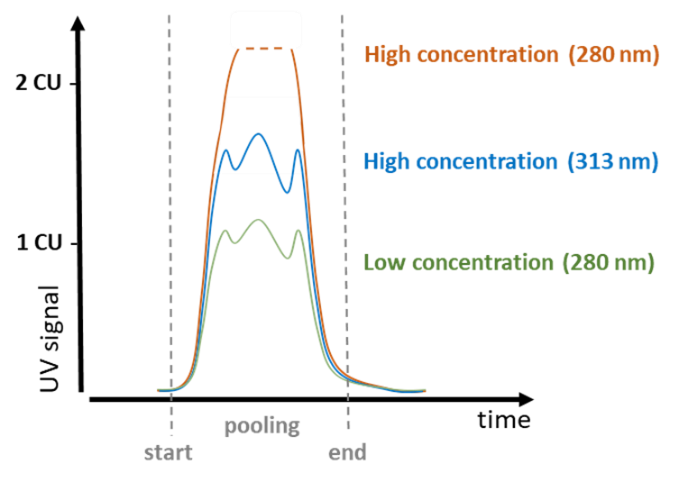
Comme c'est souvent le cas dans les applications biotechnologiques pour caractériser l'état de mise en commun des protéines, alors que la longueur d'onde de 280 nm peut être parfaitement utilisée pour des concentrations plus faibles, le pic dépassera facilement la CU maximale (unité de concentration) et toute structure de pic est perdue. Ici, à la bride du pic principal, à > 300 nm par exemple, une mesure peut être effectuée, là où des concentrations plus élevées donnent encore des pics structurés.